Атом құрылысының заманауи теориясы, атомдағы электрондардың қозғалысы 2-сабақ (Химия, 10 сынып, I тоқсан)
Пән: Химия
Ұзақ мерзімді жоспар бөлімі: Атом құрылысы
Сабақ тақырыбы: Атом құрылысының заманауи теориясы, атомдағы электрондардың қозғалысы 2-сабақ
Осы сабақта қол жеткізілетін оқу мақсаттары: 10.1.2.1 атом құрылысының заманауи теориясын біледі;
10.1.2.2 s, p, d, f орбитальдерінің пішінін ажыратады;
Сабақ мақсаттары: -атомдағы электрондардың ядродан арақашықтықтары алыстай түсетін орбиталдар бойында орналасатындығын түсіну;
- әрбір электрондық қабат белгілі электрон сиымдылығына ие екендігін түсіну;
Ұйымдастыру сәті. Амандасу.Ынтымақтастыру атмосферасын құру.
Активити «Ең жақсы қасиет» (Парта бойынша көршісінің ең жақсы қасиеттерін сипаттау және осы қасиеттерді сыйлауды сұраңыз).
Бейнебаян қарау:
**Материяның күрделі құрылысы
Жұмбақ бейнебаян.
Бүгінгі сабағымыздың тақырыбы неге байланысты болады?
Сабақтың тақырыбын, оқу мақсаттарын және жетістік критерийлерін анықтау.
Барлық заттардың негізі – атом болып табылады.
Сұрақтар:
**Атом туралы не білесіздер?
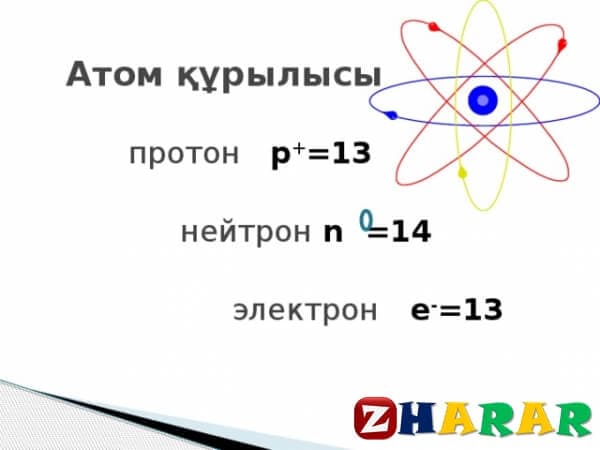
Атом үш негізді субатомдық бөлшектен құралады; олар:
электрондар, протондар және нейтрондар. Тығыз жинақталған протондар мен нейтрондар атом ядросын түзеді, ал электрондар оның айналасында жеке траектория бойымен қозғалады.
Бейнебаян қарау:
** Атом деген не?
Тапсырма:
Хлор атомының ХЭПЖ-гі орнын көрсетіп, ядро құрамын анықтаңыз.
Атом құрылысының планеталық моделі әрбір орбитальда бір электронның бар болуын тұжырымдайды. Қазіргі кезде электрондық қабат 7 орбитальдан тұратыны белгілі...
Кіріспе сұрақ: Атом электрондары орбиталдарда қалай(қаншадан) орналасады?
Кесте бойынша жұмыс (оқушылар дайын ақпарат арқылы
қарастырады):
Мұғалімнің жаңа ақпаратты түсіндіріуі:
Электрондардың энергетикалық деңгей бойынша орналасуы. Атомдағы электрондардың күйлері.
Атомдағы электрондар әртүрлі энегрияға ие, олар энергияны белгілі бір мөлшерде(нақтырақ айтсақ, квант) сіңіре немесе шығара алады.
Атомда электрон тек қана белгілі бір кванттық күйлерде бола алады, бұл электронның ядромен байланысын көрсететін энергиясына сәйкес.
Электрон энергиясының мәні бас квант санымен (n) көрсетіледі, ол тек қана бүтін сандармен жазылуы мүмкін: n=1, 2,3… .
Энергия қоры ең төмен электрондар (n=1 ), бірінші энергетикалық деңгейде орналасады. Мысалы:
Электрондардың бір кванттық күйден басқаға көшуі – энегрияның өзгеруіне байланысты, сондықтан электрондар екінші немесе одан да жоғары энергетикалық деңгейге өте алады.
Энергетикалық деңгейдегі электрондардың саны(N) мына формуламен анықталады: N=2n2 ,
n – бас квант саны.
Бұл формулаға сәйкес:
бірінші энергетикалық деңгейде (n=1) 2 электрон орналаса алады. (N=2 ∙ 12 = 2),
екіншіде (n=2) – 8 электрон (N=2 ∙ 22 = 8),
үшіншіде (n=3) – 18 электрон (N=2 ∙ 32 = 18 ) т.с.с.
**Орбиталдар әртүрлі пішінде болуы мүмкін.
Әрбір жаңа энергетикалық деңгейі, бір s-орбиталдан басталады, оның пішіні шар тәрізді болады. Екінші және одан кейінгі деңгейлерде бір s-орбиталь және үш р-орбиталь пайда пайда болады, р-орбиталдың пішіні гантел тәрізді.......
Ұзақ мерзімді жоспар бөлімі: Атом құрылысы
Сабақ тақырыбы: Атом құрылысының заманауи теориясы, атомдағы электрондардың қозғалысы 2-сабақ
Осы сабақта қол жеткізілетін оқу мақсаттары: 10.1.2.1 атом құрылысының заманауи теориясын біледі;
10.1.2.2 s, p, d, f орбитальдерінің пішінін ажыратады;
Сабақ мақсаттары: -атомдағы электрондардың ядродан арақашықтықтары алыстай түсетін орбиталдар бойында орналасатындығын түсіну;
- әрбір электрондық қабат белгілі электрон сиымдылығына ие екендігін түсіну;
Ұйымдастыру сәті. Амандасу.Ынтымақтастыру атмосферасын құру.
Активити «Ең жақсы қасиет» (Парта бойынша көршісінің ең жақсы қасиеттерін сипаттау және осы қасиеттерді сыйлауды сұраңыз).
Бейнебаян қарау:
**Материяның күрделі құрылысы
Жұмбақ бейнебаян.
Бүгінгі сабағымыздың тақырыбы неге байланысты болады?
Сабақтың тақырыбын, оқу мақсаттарын және жетістік критерийлерін анықтау.
Барлық заттардың негізі – атом болып табылады.
Сұрақтар:
**Атом туралы не білесіздер?
Атом үш негізді субатомдық бөлшектен құралады; олар:
электрондар, протондар және нейтрондар. Тығыз жинақталған протондар мен нейтрондар атом ядросын түзеді, ал электрондар оның айналасында жеке траектория бойымен қозғалады.
Бейнебаян қарау:
** Атом деген не?
Тапсырма:
Хлор атомының ХЭПЖ-гі орнын көрсетіп, ядро құрамын анықтаңыз.
Атом құрылысының планеталық моделі әрбір орбитальда бір электронның бар болуын тұжырымдайды. Қазіргі кезде электрондық қабат 7 орбитальдан тұратыны белгілі...
Кіріспе сұрақ: Атом электрондары орбиталдарда қалай(қаншадан) орналасады?
Кесте бойынша жұмыс (оқушылар дайын ақпарат арқылы
қарастырады):
Мұғалімнің жаңа ақпаратты түсіндіріуі:
Электрондардың энергетикалық деңгей бойынша орналасуы. Атомдағы электрондардың күйлері.
Атомдағы электрондар әртүрлі энегрияға ие, олар энергияны белгілі бір мөлшерде(нақтырақ айтсақ, квант) сіңіре немесе шығара алады.
Атомда электрон тек қана белгілі бір кванттық күйлерде бола алады, бұл электронның ядромен байланысын көрсететін энергиясына сәйкес.
Электрон энергиясының мәні бас квант санымен (n) көрсетіледі, ол тек қана бүтін сандармен жазылуы мүмкін: n=1, 2,3… .
Энергия қоры ең төмен электрондар (n=1 ), бірінші энергетикалық деңгейде орналасады. Мысалы:
Электрондардың бір кванттық күйден басқаға көшуі – энегрияның өзгеруіне байланысты, сондықтан электрондар екінші немесе одан да жоғары энергетикалық деңгейге өте алады.
Энергетикалық деңгейдегі электрондардың саны(N) мына формуламен анықталады: N=2n2 ,
n – бас квант саны.
Бұл формулаға сәйкес:
бірінші энергетикалық деңгейде (n=1) 2 электрон орналаса алады. (N=2 ∙ 12 = 2),
екіншіде (n=2) – 8 электрон (N=2 ∙ 22 = 8),
үшіншіде (n=3) – 18 электрон (N=2 ∙ 32 = 18 ) т.с.с.
**Орбиталдар әртүрлі пішінде болуы мүмкін.
Әрбір жаңа энергетикалық деңгейі, бір s-орбиталдан басталады, оның пішіні шар тәрізді болады. Екінші және одан кейінгі деңгейлерде бір s-орбиталь және үш р-орбиталь пайда пайда болады, р-орбиталдың пішіні гантел тәрізді.......
Толық нұсқасын 30 секундтан кейін жүктей аласыз!!!
Қарап көріңіз 👇
Пайдалы сілтемелер:
» Туған күнге 99 тілектер жинағы: өз сөзімен, қысқаша, қарапайым туған күнге тілек
» Абай Құнанбаев барлық өлеңдер жинағын жүктеу, оқу
» Дастархан батасы: дастарханға бата беру, ас қайыру



Посетители, находящиеся в группе Читатель, не могут оставлять комментарии к данной публикации.
Ілмектер: умж ұмж қмж кмж сабақ жоспары Атом құрылысының заманауи теориясы атомдағы электрондардың қозғалысы 2-сабақ 10 сынып химия, химиядан қмж кмж ұмж умж ұзақ мерзімді қысқа сабақ жоспары, долгосрочный и краткосрочный план на казахском, химия умж ұмж кмж қмж кыска узак мерзимди сабак жоспары, Атом құрылысының заманауи теориясы атомдағы электрондардың қозғалысы 2-сабақ